纳米金刚石:更有效地杀灭肿瘤干细胞
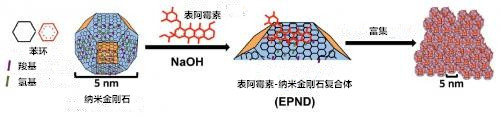
图1:纳米金刚石(ND)与表阿霉素(EPI)的表层化学结构示意图及表阿霉素-纳米金刚石复合体(EPND)的合成过程。ND呈截角八面体结构,其表面电荷用颜色区分;已标注的表面功能团有苯环、羧基和氢基。红色的分子骨架是碳、氧、氢原子组成的EPI分子。
由新加坡国立大学负责的一项研究发现化疗药物表阿霉素加载到纳米金刚石上形成的复合体可有效消灭抗拒化疗的肿瘤干细胞。研究结果发表于2014年12月美国化学学会出版的ACS Nano期刊上。
由新加坡癌症科学研究所的青年首席科学家及新加坡国立大学副教授Edward Chow带领的研究小组证明了如何使常见的化疗药物利用纳米技术对抗具有耐药性的肿瘤干细胞。耐药性是指肿瘤细胞对化疗的抵抗性,是临床治疗失败的主要原因。肿瘤干细胞具有形成肿瘤的潜力,对化疗的抵抗性比普通肿瘤细胞更强,是化疗后癌症复发的主要原因。因此,为了解决其耐药性,尤其是肿瘤干细胞的耐药性,业内研究人员一直在孜孜不倦地研发新药物或新治疗方法。
该项研究中,EPND是通过常见的抗癌药物EPI吸附在纳米载体ND(直径约为5nm的碳结构材料)上形成药物复合物。结果发现,EPI和EPND都具有杀死常规肿瘤细胞的能力,但仅EPND可杀死肿瘤干细胞,防止肝癌异种移植模型中形成次发性肿瘤。
与其他方法(如药物+抑制剂的组合疗法)相比,抗肿瘤药物的纳米给药系统使经包裹的抗肿瘤药物的药物活性得以保护,疗效更好。结果显示,表阿霉素的平均致死剂量在EPI-ND的给药系统中反而安全有效。因此,以ND为纳米载体的化疗药物不仅提高了对肿瘤干细胞的治疗效果,而且患者无需忍受化疗药物副作用带来的痛苦。
除此以外,以ND为载体的药物递送方式也可使ND用于递送类似药物和主动靶向成分,例如可用于抗体及多肽通过肿瘤细胞表面蛋白释放靶向药物。此外,以ND为纳米载体的给药系统不仅可治疗肝癌,它还有望治疗其他疑难癌症,尤其是肿瘤干细胞引发的癌症。
该课题组现正与加州大学洛杉矶分校的 Dean Ho 教授、北京大学的 Li Jianzhong 教授合作进行蒽环类抗肿瘤药的 ND 纳米载体给药系统的临床前实验,并有望在近期展开相关临床实验。
- 上一篇 >发行规模大增 2022年绿色债券市场扩容可期2022-02-17
- < 下一篇将二氧化碳转化为绿色能源电池2016-03-07





